細菌涂片及細菌染色是微生物學的基本技術,也是觀察細菌很簡單且行之有效的方法,是微生物檢測人員常用技能之一。通常情況下,由于細菌個體較小,較透明或半透明,如未經染色往往不以觀察識別。因此借助于染色法可以使細菌著色,與視野背景形成鮮明對比,從而易于在顯微鏡下進行觀察。
微生物檢測常見的細菌染色方法包括簡單染色、負染色、革蘭氏染色、芽孢染色法、鞭毛染色、莢膜染色、死活染色。制備細菌染色片一般要經過涂片、固定、染色、水洗、干燥等步驟,然后顯微鏡廠家微儀顯微鏡觀察。

5. 鞭毛染色法
鞭毛是細菌的運動器官,非常纖細,超出了光學顯微鏡觀察尤限,因此通常情況下在顯微鏡下觀察不到。通過特殊的染色技術,可以將染色液附加到鞭毛的周圍,增加它的直徑,從而能在光學顯微鏡下觀察到鞭毛。鞭毛染色一般分銀鹽法和復紅沉淀法兩種。
這里介紹一下銀鹽沉淀法。用作鞭毛染色的載玻片要是相對干凈無油脂的,將載玻片在火焰上快速灼燒5s,放在染色架上冷卻,用蠟筆分成兩個區域,然后用移液管或者巴斯德移液管吸取2mL無菌水加入到幼齡生長活躍的斜面菌株中,慢慢震蕩并旋轉試管使菌株懸浮,盡量避免使用接種環,將懸液轉移到干凈的試管中,通過懸滴試驗檢查菌體的運動型,用無菌水將懸浮液稀釋至略有渾濁為止,放入20-30℃培養箱中培養30min,然后移取一滿環懸浮液加在已冷卻的載玻片一端,傾斜載玻片讓液滴流到蠟筆畫的中心線,在空氣中自然干燥。然后用媒染色劑媒染5min之后,慢慢用蒸餾水充分漂洗掉所有的媒染液,用熱的Fontana銀鹽覆蓋,染色5min,每隔1min更換一次染色液(Fontana銀液在沸水浴中加熱),細菌涂層的每一部分都要浸在染色液中,不能裸露。用水沖洗,自然晾干即可進行鏡檢。應當注意一點,染色法的燃料須當日配制,4h內使用,現配現用。
6. 莢膜染色
一般細菌的莢膜與染色劑的親和性低,但莢膜通透性高,因此染料可以透過莢膜使菌體著色。一般采用負染色方法使背景和菌體之間形成一透明區,將菌體襯托出來便于觀察分辨。
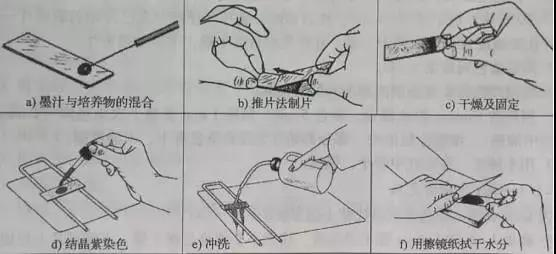
莢膜染色的步驟:加一滴6%葡萄糖水溶液在載玻片的一端,無菌操作,挑取細菌斜面上培養72h左右的膠質芽孢桿菌與其混合,加1滴墨汁充分混勻,用推片法制片將菌液鋪成薄層,自然干燥,滴加1-2滴無水乙醇覆蓋涂片,固定1min,自然干燥,在已晾干的涂面上,滴加1%結晶紫染色液染色,2min后用20%的硫酸銅沖洗數次,再用自來水沖洗一次,使用擦鏡紙擦干后即可鏡檢。有莢膜的菌菌體呈紫色,背景灰黑色,莢膜不著色呈無色透明圈。具體操作過程見下圖:
7. 死活染色
細菌死活染色排除法是生物研究中判斷細胞活性的一種常用方法,是利用死活細胞在生理機能和性質上的差異來進行的,常用的染色劑有臺盼藍和美藍,前者使用范圍較廣,后者一般在酵母菌細胞死活鑒定上使用較多。
以上就是顯微鏡廠家介紹的細菌染色法,基本上涵蓋傳統微生物實驗室能用到的所有的細菌染色法。染色法在細菌的觀察、分類、鑒定中經常用到,因此是微生物檢測人員不可或缺的基本技能之一。
文章內容來源:環凱微生物